Wie es mit den Impfstoff-Studien weitergehen soll
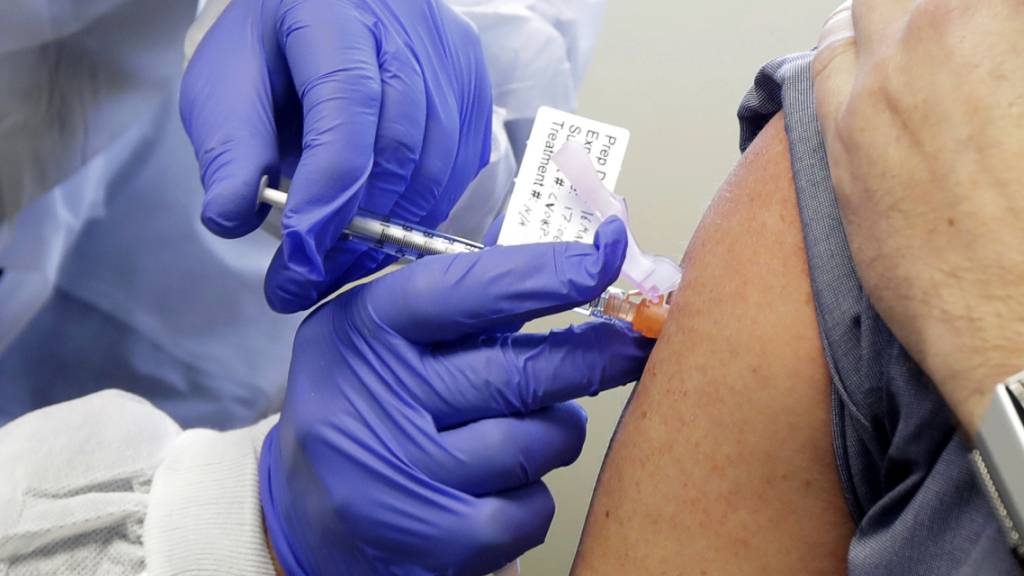
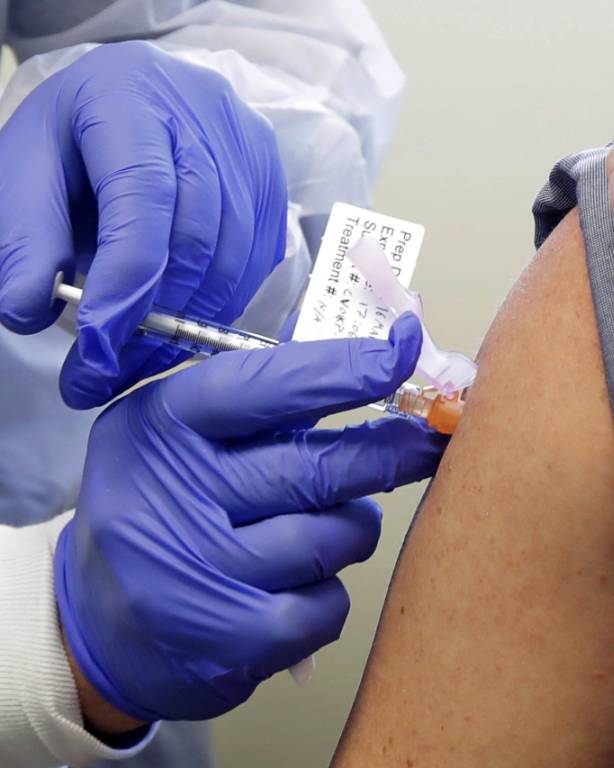
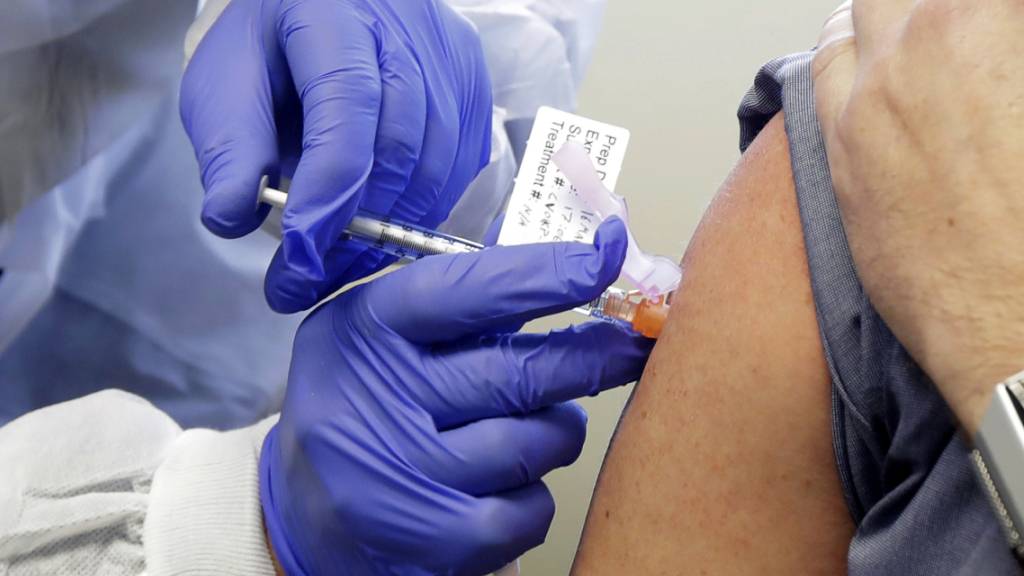
In der medizinischen Forschung ist es üblich, dass die eine Hälfte der Studienteilnehmer den Wirkstoff, die andere ein Placebo erhält. So lassen sich Wirksamkeit und Sicherheit der Vakzine überprüfen. Doch ist es ethisch vertretbar, Placebo-Probanden nach der Zulassung einen wirksamen Impfstoff vorzuenthalten, um Langzeitfolgen zu untersuchen?
Eine «graue Zone»
Das seien Fragen, mit denen man sich vor der Corona-Pandemie nur selten beschäftigen musste, sagte die Medizinethikerin Samia Hurst von der Universität Genf im Gespräch mit der Nachrichtenagentur Keystone-SDA. Mit der noch nie dagewesenen Geschwindigkeit eröffne sich eine «graue Zone».
Was sie damit meint: Sobald ein Impfstoff als Standard in der medizinischen Versorgung anerkannt ist, müssen auch die Placebo-Teilnehmer den wirksamen Impfstoff erhalten.
Doch solange die Vakzine knapp seien und bestimmte Personengruppen Vorrang hätten, würde man gewissen Menschen nichts vorenthalten, sagte Hurst. «In dieser Zeit kann es unter Umständen ethisch vertretbar sein, bestimmten Probanden nach wie vor Placebos zu verabreichen.»
Und was passiert, sobald alle Studienteilnehmer geimpft wurden? «Man kann Langzeitfolgen auch ohne Placebo-Gruppen untersuchen», sagte der Epidemiologe Marcel Tanner von der wissenschaftlichen Taskforce. Mit Impfregister liesse sich zu jeder Zeit bestimmen, welche Nebenwirkungen bei Geimpften und welche bei Nicht-Geimpften auftreten würden.
Rennen nicht beendet
Noch befinden sich rund um den Globus über 180 Covid-19-Impfstoffe im Rennen. Das ist wichtig, denn möglicherweise werden mehrere Impfstoffe benötigt, um den weltweiten Bedarf zu decken. Auch könnten sich gewisse Vakzine etwa für Diabetiker, Senioren oder HIV-Patienten als besser erweisen. Doch dafür müssen sich auch diese Impfstoffe in grossen Phase-3-Studien mit tausenden Probanden beweisen.
«Das Studiendesign kann dann vorsehen, dem einen Arm den zu erforschenden Impfstoff zu verabreichen, der Kontrollgruppe den bereits registrierten Impfstoff», sagte Tanner. So liesse sich beobachten, ob der neue Impfstoff mindestens gleich wirksam und sicher sei wie der zugelassene.
Aber ist es ethisch vertretbar, der Kontrollgruppe einen bereits zugelassenen Impfstoff vorzuenthalten? Unter Umständen Ja, wie US-Forschende um David Wendler im Fachmagazin «Science» schreiben. Die Autoren legen Wissenschaftlern in laufenden Impfstoffstudien nahe, Risikopersonen auszuschliessen, aber weiterhin wertvolle Daten von Teilnehmern zu sammeln, die ein geringes Risiko haben, ernsthafte Schäden durch die Krankheit zu erleiden.